Лента новостей → Прививки от COVID-19 «Синофарм», «Оксфорд-АстраЗенека» и «Пфайзер-БиоНТех»: проверка эффективности с помощью КТ-волюметрии легких со сравнительным дисперсионным анализом (ANOVA)
Данные
В нескольких клинических исследованиях была проверена эффективность различных прививок от COVID-19, в то время как ранее очень немногие радиологические исследования были посвящены этой проблеме.
Цель работы
Проверить аддитивную роль КТ-волюметрии легких в тестировании эффективности трех широко распространенных вакцин против COVID-19; а именно вакцины “Sinopharm”, “Oxford-AstraZeneca” и “Pfizer-BioNTech” со сравнительным дисперсионным анализом (ANOVA).
Полученные результаты
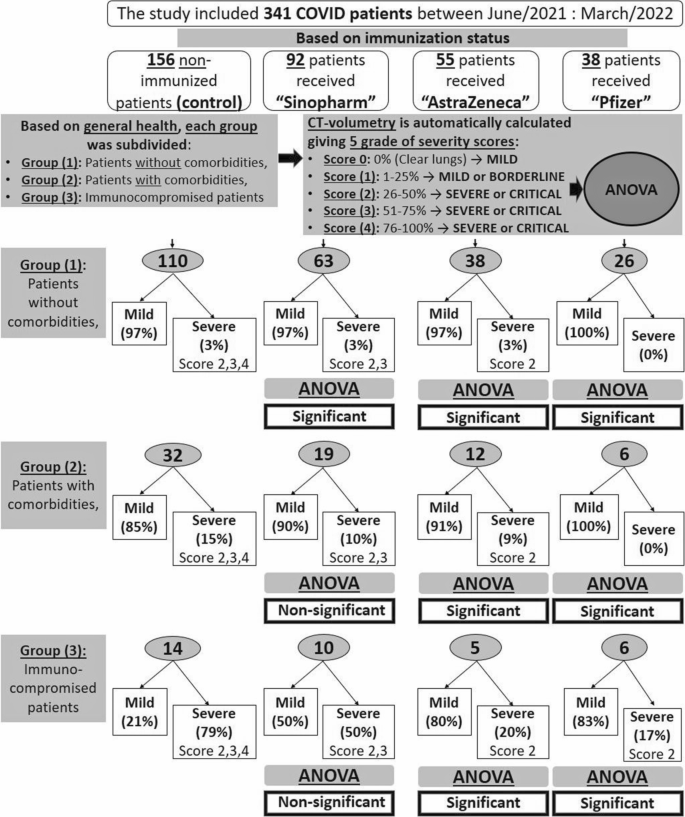
Это исследование было ретроспективно проведено на 341 пациенте с COVID-19 в период с июня 2021 года по март 2022 года. На основании статуса иммунизации они были разделены на четыре группы; в группу (А) вошли 156/341 (46%) больные, не получавшие никакой вакцинации (контрольная группа), в группу (Б) вошли 92/341 (27%) больные, получившие вакцину «Синофарм», в группу (С) вошли 55 /341 (16 %) пациент, получивший вакцину «Оксфорд-АстраЗенека», в группу (D) вошли 38/341 (11 %) пациент, получивший вакцину «Pfizer-BioNTech». Каждая группа была разделена на основе истории болезни на три группы; группа (1) – пациенты без сопутствующих заболеваний, группа (2) – пациенты с сопутствующими заболеваниями и группа (3) – пациенты с ослабленным иммунитетом. Автоматизированная КТ-волюметрия была рассчитана для патологической паренхимы легкого. Было предоставлено пять баллов тяжести КТ (0 баллов = 0%, 1 балл = 1–25%, 2 балла = 25–50%, 3 балла = 51–75% и 4 балла = 76–100%). Был использован дисперсионный анализ (ANOVA), включая тест Tukey HSD, по сравнению с неиммунизированными пациентами. Вакцина «Физер-Бионтех» позволила устранить тяжесть течения у больных без и с сопутствующей патологией, а также снизить тяжесть у больных с иммунодефицитом (с 79 до 17%). Вакцина «Оксфорд-АстраЗенека» и в меньшей степени вакцина «Синофарм» также снижали клиническую тяжесть у пациентов с сопутствующими заболеваниями и пациентов с ослабленным иммунитетом (с 15 до 9% и 10%, а также с 79 до 20% и 50% соответственно). . Доказаны значительные расхождения в отношении использования «Синофарм», «Оксфорд-АстраЗенека» и «Физер-Бионтех».f -соотношение составило в среднем 4,0282, 10,8049 и 8,4404 соответственно, а также p -значение в среднем составило 0,04632, 0,001268 и 0,004294). Доказана значительная дисперсия в отношении применения вакцин «Оксфорд-АстраЗенека» и «Физер-Бионтех» у пациентов с сопутствующими заболеваниями и у пациентов с иммунодефицитом ( f -соотношение составило в среднем 4,7521 и 4,1682, а также 11,7811 и 15,6 соответственно, также значение p в среднем 0,03492 и 0,04857, а также 0,003177 и 0,0009394 соответственно, все <0,05). Достоверной разницы в применении вакцины «Синофарм» не доказано.
Выводы
Помимо снижения показателей клинической тяжести и показателей тяжести по КТ, была доказана значительная дисперсия в отношении использования вакцин «Синофарм», «Оксфорд-АстраЗенека» и «Физер-Бионтех» у пациентов без сопутствующих заболеваний. Достоверная дисперсия также была доказана в отношении применения вакцин «Оксфорд-АстраЗенека» и «Физер-Бионтех» у пациентов с сопутствующими заболеваниями и у пациентов с иммунодефицитом. Несмотря на это, достоверной разницы в применении вакцины «Синофарм» у этих пациентов не доказано, она снижает процент клинической тяжести и баллы тяжести по КТ.
Данные
Человечество три года страдает от пандемии COVID-19. Сообщалось о миллионах смертей. Жизнь других людей оказалась под угрозой. Социально-экономический компромисс был жестоким. Медицинские учреждения были истощены. С тех пор разные страны усердно работали над производством эффективных вакцин [ 1 ]. Они стремились улучшить выживаемость инфицированных пациентов, поскольку хорошо известно, что доступные вакцины против COVID-19 не предотвращают инфекции или повторные инфекции, но снижают заболеваемость и смертность. Они могут облегчить тяжесть симптомов и снизить потребность в госпитализации и нагрузку на общественные медицинские учреждения. Кроме того, они могут ограничивать распространение инфекции от бессимптомных лиц [ 2 , 3 , 4].].
Разработаны и одобрены для экстренного применения разные типы вакцин с разными механизмами действия [ 5 , 6 ]. Они внедрили мРНК-вакцины, такие как Pfizer-BioNTech, и рутинные инактивированные вакцины, такие как Sinopharm [ 7 ]. Существовала также вакцина «Оксфорд-АстраЗенека» ChAdOx1 nCoV-19 (AZD1222), которая состоит из дефицитного по репликации аденовирусного вектора шимпанзе ChAdOx1, который несет ген структурного поверхностного гликопротеинового антигена SARS-CoV-2 (шипообразный белок; nCoV-19) [8] . ].
Титр антител и влияние на клиническое течение были основными параметрами, которые использовались для определения эффективности вакцинации в нескольких предыдущих клинических исследованиях [ 7 ].
Большинство предыдущих радиологических исследований сосредоточено на подводных камнях поствакцинальной визуализации, особенно при исследованиях с помощью позитронно-эмиссионной томографии (ПЭТ/КТ). Между тем, очень немногие предыдущие радиологические исследования были направлены на оценку эффективности вакцинации [ 9 ].
Цель работы: уточнить аддитивную роль КТ-волюметрии легких в тестировании эффективности трех широко распространенных вакцин против COVID-19; а именно вакцины «Sinopharm/ BBIBP-CorVi », «Oxford-AstraZeneca/ChAdOx1 nCoV-19 (AZD1222)» и «Pfizer-BioNTech» со сравнительным дисперсионным анализом (ANOVA).
Методы
Блок-схема демонстрирует план исследования, методологию и краткие результаты. (Рис. 1 )
Это исследование было ретроспективно проведено на 341 пациенте, у которого была подтверждена инфекция COVID-19 с помощью ПЦР-тестирования, и которые имели право на КТ грудной клетки в период с июня/2021 г. по март/2022 г. Они были разделены в зависимости от статуса иммунизации на четыре группы, в том числе пациенты с отрицательным анамнезом вакцинации (контрольная группа А) и пациенты, получившие полную схему вакцины «Синофарм», «Оксфорд-АстрЗенека» или «Пфайзер-БиоНТек». (группа В, С и D). Инфекция COVID-19 была подтверждена через один-шесть месяцев после получения полной схемы вакцинации. Каждая группа была дополнительно разделена на три группы в зависимости от общего состояния здоровья пациентов и истории болезни; группа (1) – здоровые лица без сопутствующих заболеваний, группа (2) – больные с хроническими сопутствующими заболеваниями, и группа (3), включающая пациентов с ослабленным иммунитетом. HRCT была выполнена для каждой группы. Автоматизированная КТ-волюметрия рассчитывалась для патологических участков легких. Пять оценок были разделены на основе показателя КТ-объема (0 баллов = 0%, 1 балл = 1–25%, 2 балла = 25–50%, 3 балла = 51–75% и 4 балла = 76–100%). ). Был использован дисперсионный анализ (ANOVA), включая тестирование Tukey HSD.
Критерии включения были следующими: (1) пациенты с подтвержденной инфекцией COVID-19 с помощью ПЦР-тестирования и не получали какой-либо вакцины, и (2) пациенты с подтвержденной инфекцией COVID-19 с помощью ПЦР и получали полный курс либо «Синофарм », или «Оксфорд-АстраЗенека», или «Физер» прививки за один-шесть месяцев до заражения.
Критериями исключения были следующие: (1) плохое качество КТ-изображений из-за тахипноэ и неизбежных артефактов дыхательных движений, (2) пациенты, не завершившие режим иммунизации, и (3) пациенты, инфицированные в течение первого месяца после завершения вакцинации. режима из-за недостаточной продолжительности для выработки антител.
Исследование было одобрено «Институциональным комитетом по этике». Убедившись в полном соблюдении конфиденциальности личных данных и медицинских записей, «Совет по этике исследований» отказался от согласия пациента.
Эта рукопись не пересекается с ранее опубликованными работами.
В этом исследовании участвовали три эксперта-радиолога-консультанта и один пульмонолог-консультант; радиологический стаж варьировал от 11 до 26 лет, а клинический стаж в среднем составлял 17 лет. Рентгенологи работали вместе в согласии, и они были ослеплены клиническими данными и историей иммунизации.
КТ-сканирование и КТ-объемометрия
КТ грудной клетки с высоким разрешением (HRCT) выполняли на нескольких мультидетекторных КТ-аппаратах: (1) SOMATOM Sensation 64, Siemens Medical Systems, Германия, (2) Canon Medical Systems; Toshiba Aquilion 64, Япония, и (3) Canon Medical Systems; Toshiba Aquilion CXL/CX 128, Япония.
Параметры сканирования для КТ грудной клетки были следующими: [ 1 ] Толщина среза: 1–1,25 мм, [ 2 ] Вращение трубки: 0,6–0,9 с, [ 3 ] Коллимация детектора 1 мм, [ 4 ] 120– 130 кВп, 200 мА и [ 5 ] FOV = 350 мм × 350 мм. Исследования проводились без внутривенного введения контраста.
КТ-волюметрия проводилась с использованием программного обеспечения OsiriX MD 11.0 (Pixmeo SARL, Женева, Швейцария), поэтому вариативность аппаратов КТ не повлияла на эту количественную оценку. Автоматический расчет патологического и общего объемов легких был выполнен с использованием настройки порогового интервала во время реконструкции области интереса (ROI) с цветовой кодировкой 2D/3D. Интервал для расчета общего объема легких находился в пределах (0:-1024 Hu), в то время как интервал для оценки патологического объема легких находился в пределах (0:-700 Hu).
Пять степеней тяжести были разделены на основе оценки КТ-объема (0 баллов = 0%, 1 балл = 1–25%, 2 балла = 25–50%, 3 балла = 51–75% и 4 балла = 76–100). %).
Морфологическая КТ-оценка также проводилась на основе универсальных КТ-признаков диагноза COVID-19, в частности КТ-признаков тяжести, включая «сумасшедшую мостовую» [ 9 ].
Клинический вклад
Основная клиническая роль заключалась в сборе подробного анамнеза иммунизационного статуса. Далее проводилась корреляция с клиническим течением и исходом. Он следовал универсальным критериям классификации клинической тяжести, в том числе; Насыщение кислородом в воздухе помещения (O2-RA), наличие и степень одышки и частота дыхания (RR) [ 10 ]. Пациенты в тяжелом или критическом состоянии с O2-RA < 93% и ЧД > 30/мин госпитализировались в больницу или даже в отделение интенсивной терапии (ОИТ), получая специальный протокол лечения, включающий стероиды, противовирусные препараты и респираторную поддержку, начиная с начальная высокопоточная назальная оксигенотерапия вплоть до искусственной вентиляции легких [ 10 ].
Статистический анализ
Он включал: (1) оценку распространенности и соотношения демографических факторов, клинической тяжести и показателей тяжести по КТ. (2) Оценка среднего, стандартного отклонения (SD), нормальности, асимметрии и избыточного эксцесса для каждой основной и подгруппы пациентов в дополнение к коэффициенту f , значению p , величине эффекта и η2 (отклонение от среднего) из анализа ANOVA с Tukey HSD с использованием онлайн-калькулятора ( https://www.https://www.statskingdom.com/180Anova1way.html ). Значение p (<0,05) считалось статистически значимым.
Полученные результаты
На основании статуса иммунизации 341 пациент с COVID-19 был разделен на четыре группы; в группу (А) вошли 156/341 (46%) больных, которые ранее не получали вакцинацию и считались контрольной группой, в группу (Б) вошли 92/341 (27%) пациенты, получившие две дозы вакцины «Синофарм» , в группу (С) вошли 55/341 (16%) пациентов, получивших две дозы вакцины «Оксфорд-АстраЗенека», в группу (Г) вошли 38/341 (11%) пациентов, получивших однократную дозу «Пфайзер-БиоНТек». вакцина. Пациенты в каждой группе были дополнительно подразделены в зависимости от наличия или отсутствия сопутствующей патологии или статуса иммунодефицита.
Рентгенологическая и клиническая тяжесть в целом составляла 7 и 12,1% у вакцинированных и невакцинированных пациентов соответственно. Поразительно, что он был выше у пациентов с ослабленным иммунитетом по сравнению с другими пациентами без товаров или с товарами (достигая 79% у невакцинированных пациентов и колеблется от 17 до 50% у вакцинированных пациентов).
Пациенты с хорошим общим состоянием здоровья и отсутствием сопутствующей патологии
Вакцина «Физер-Бионтех» позволила устранить тяжесть течения заболевания у инфицированных пациентов с хорошим общим состоянием здоровья и отсутствием сопутствующей патологии.
Несмотря на то, что клиническая тяжесть в среднем составляла 3% у неиммунизированных пациентов, а также у пациентов, получавших «Синофарм» и у пациентов, получавших «Оксфорд-АстраЗенека», показатели тяжести по КТ снижались у пациентов, получавших «Оксфорд-АстраЗенека» (балл 2) и «Синофарм» получили пациентов (2–3 балла) по сравнению с неиммунизированными пациентами (достигли 4 балла).
Это подробно описано следующим образом:
Неиммунизированные пациенты (контрольная группа)
Их было 110/156 (71%) больных. Их возраст колебался от 18 до 56 лет при соотношении мужчин и женщин 3:2. (Таблица 1 ). Клинически у 107/110 (97%) пациентов заболевание было легким. По данным КТ-волюмометрии 25 (23%) пациентов набрали (0) и 82 (74%) пациента – (1). Между тем, 3 из 110 (3%) пациентов были клинически тяжелыми или критическими, показывали «сумасшедший рисунок мостовой» в HRCT и были госпитализированы. один (1%) пациент набрал (2), один (1%) пациент набрал (3) и один (1%) пациент набрал (4). (таблицы 1 , 2 ).
«Синофрам» принял пациентов
Таких пациентов было 63/92 (68%). Их возраст колебался от 29 до 69 лет при соотношении мужчин и женщин 2:1. (Таблица 1 ). Клинически у 61/63 (97%) пациентов заболевание было легким. По данным КТ-волюмометрии 35 (56%) пациентов набрали (0) и 26 (41%) пациентов – (1) (рис. 2 ). Между тем, 2 из 63 (3%) пациентов были клинически тяжелыми или критическими, у них на КТВР наблюдалась «сумасшедшая мостовая» и они были госпитализированы. Один (1,5%) пациент набрал (2) балла (рис. 3 ) и один (1,5%) пациент набрал (3). (таблицы 1 , 2 ).
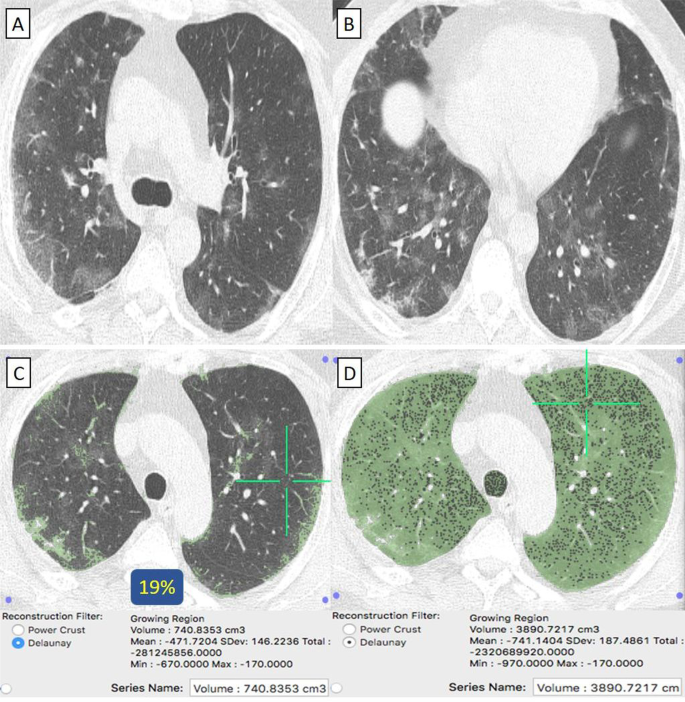
Пациентка 58 лет с отрицательным анамнезом, получившая вакцину «Синофарм», заразилась COVID-19. A , B На КТ грудной клетки в осевом направлении (окно легкого) выявлены двусторонние преимущественно периферически расположенные очаги пневмонии по типу матового стекла и минимальная правосторонняя плевральная реакция. C КТ-объем патологических отделов легких в среднем 740 куб.см. D КТ-волюметрия общего объема легких составляет в среднем 3890 куб.см. Таким образом, только 19% легочной паренхимы были поражены (оценка 1).
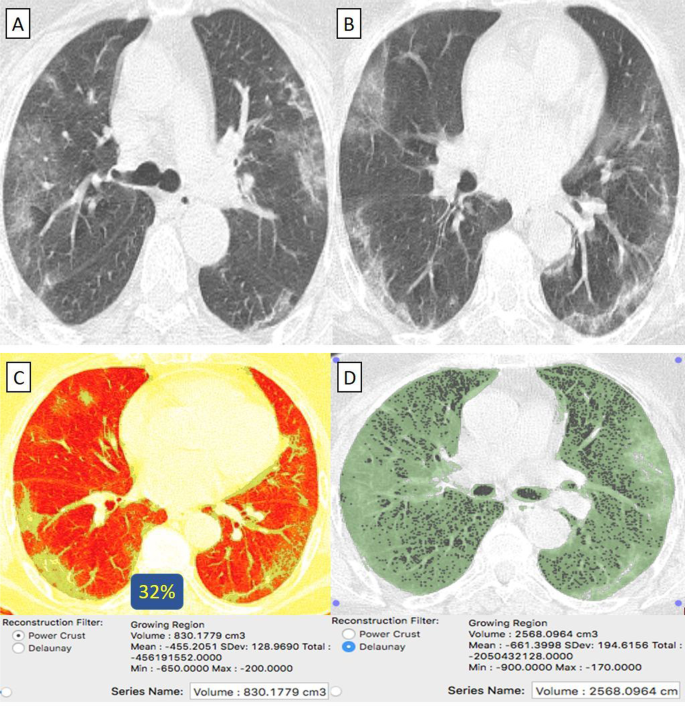
Пациентка 55 лет с отрицательным анамнезом, получившая вакцину «Синофарм», заразилась COVID-19. A , B На КТ грудной клетки в осевом направлении (окно легкого) выявлены билатеральные преимущественно периферически расположенные очаги пневмонии по типу матового стекла с периферическим субплевральным сохранением (признак Атол). C КТ-объем патологических отделов легких в среднем составляет 830 куб.см. D КТ-волюметрия общего объема легких составляет в среднем 2568 см3. Итак, 32% легочной паренхимы были поражены (2 балла).
«Оксфорд-АстраЗенека» приняла пациентов
Таких пациентов было 38/55 (69%). Их возраст колебался от 30 до 69 лет при соотношении мужчин и женщин 4:1. (Таблица 1 ). Клинически у 37/38 (97%) пациентов заболевание было легким. По данным КТ-волюмометрии 27 (71%) пациентов набрали (0) и 10 (26%) пациентов – (1) (рис. 4 ). Между тем, 1/38 (3%) пациентов были клинически тяжелыми, показывали «сумасшедший рисунок мостовой» в HRCT, были госпитализированы и получили баллы (2). (таблицы 1 , 2 ).
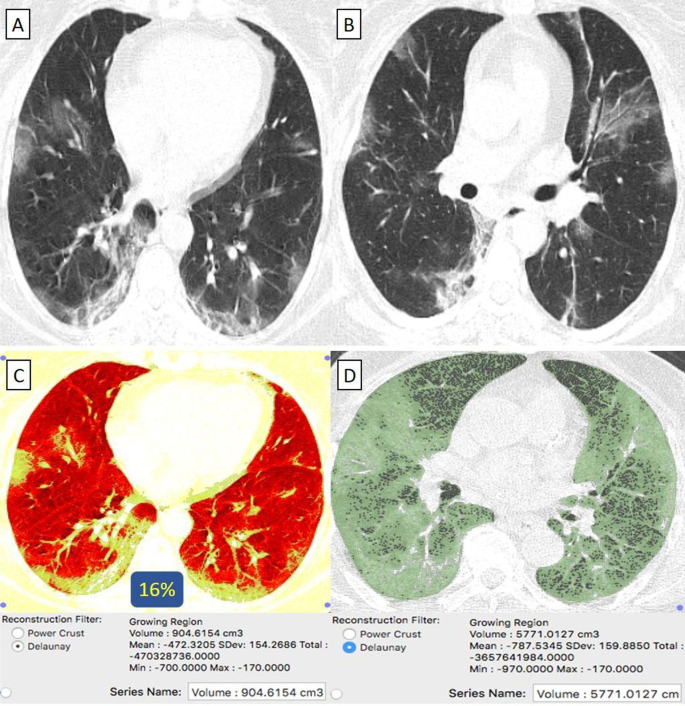
Пациентка 43 лет с отрицательным анамнезом, получившая вакцину «Оксфорд-АстраЗенека», заразилась COVID-19. A , B На КТ грудной клетки в осевом направлении (окно легкого) выявлены билатеральные преимущественно периферически расположенные пневмонические пятна в виде матового стекла и мелкие ателектатические тяжи. C КТ-объем патологических отделов легких в среднем составляет 904 куб.см. D КТ-волюметрия общего объема легких составляет в среднем 5771 куб.см. Таким образом, только 16% легочной паренхимы были поражены (оценка 1).
«Пфайзер-БиоНТех» приняла пациентов
Таких пациентов было 26/38 (68%). Их возраст колебался от 35 до 67 лет при соотношении мужчин и женщин 1:1. (Таблица 1 ) Все пациенты были клинически легкими. По данным КТ-волюмометрии 18 (69%) пациентов набрали (0) и восемь (31%) пациентов набрали (1) балл (рис. 5 ). (таблицы 1 , 2 ).
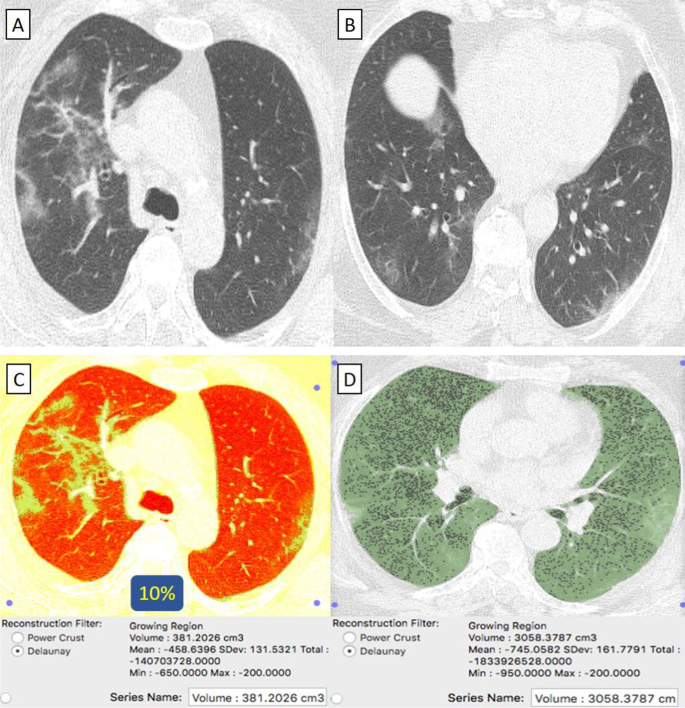
Пациентка 58 лет с отрицательным анамнезом, получившая вакцину Phizer-Biontech, заразилась COVID-19. A , B На КТ грудной клетки в осевом направлении (окно легкого) выявлены двусторонние преимущественно периферически расположенные очаги пневмонии по типу матового стекла. C КТ-объем патологических отделов легких в среднем составляет 381 куб.см. D КТ-волюметрия общего объема легких составляет в среднем 3058 куб.см. Таким образом, только 10% легочной паренхимы были поражены (оценка 1).
Пациенты с сопутствующими заболеваниями
Вакцине «Физер-Бионтех» вновь удалось снять тяжесть течения у инфицированных пациентов с сопутствующей патологией.
Вакцина «Оксфорд-АстраЗенека» и в меньшей степени вакцина «Синофарм» также снижали клиническую тяжесть (в среднем на 9% и 10% соответственно) по сравнению с 15% клинической тяжести, выявленной у неиммунизированных пациентов. Показатели тяжести КТ также снизились у пациентов, принимавших «Оксфорд-АстраЗенека» (2 балла) и пациентов, принимавших «Синофарм» (2–3 балла), по сравнению с неиммунизированными пациентами (достигли 4 балла).
Это подробно описано следующим образом:
Неиммунизированные пациенты (контрольная группа)
Их было 32/156 (21%) больных. Их возраст колебался от 39 до 71 года при соотношении мужчин и женщин 1:3. Классификация сопутствующих заболеваний описана в (табл. 1 ). Клинически у 27/32 (84%) пациентов заболевание было легким. По данным КТ-волюмометрии 5 (16%) пациентов набрали (0) и 22 (69%) пациента – (1). Между тем, 5 из 32 (16%) пациентов были клинически тяжелыми или критическими, у них на КТВР была обнаружена «сумасшедшая мостовая» и они были госпитализированы. Два (6%) пациента набрали (2), один (3%) пациент набрал (3) и два (6%) пациента набрали (4). (таблицы 1 , 2 ).
«Синофрам» принял пациентов
Таких пациентов было 19/92 (21%). Их возраст колебался от 41 до 73 лет при соотношении мужчин и женщин 2:3. Классификация сопутствующих заболеваний описана в (табл. 1 ). Клинически у 17/19 (89%) пациентов заболевание было легким. По данным КТ-волюмометрии 2 (11%) пациента набрали (0) и 15 (79%) пациентов набрали (1). Между тем, 2 из 19 (11%) пациентов были клинически тяжелыми или критическими, у них на КТВР наблюдалась «сумасшедшая мостовая» и они были госпитализированы. Один (5%) пациент набрал (2) балла (рис. 6 ) и один (5%) пациент набрал (3) балла (рис. 7 ). (таблицы 1 , 2 ).
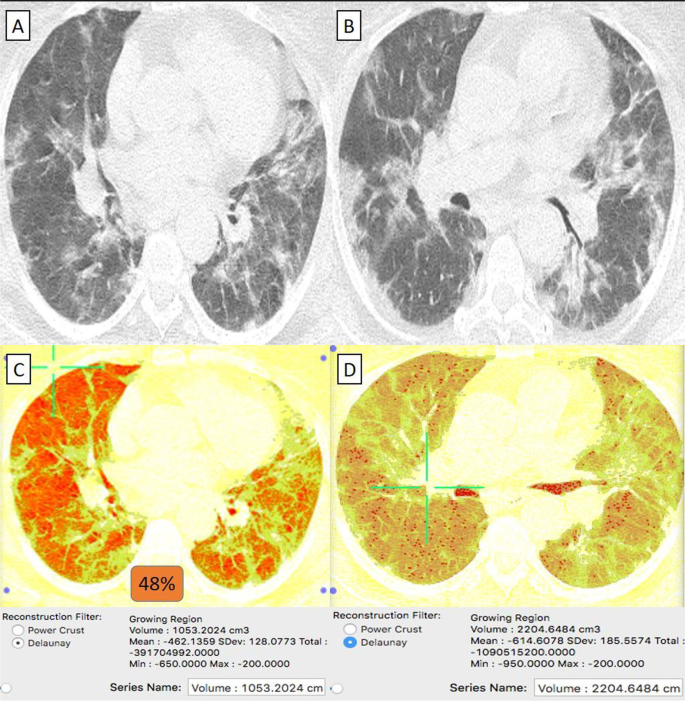
69-летняя пациентка с сердечным заболеванием и диабетом, получившая вакцину «Синофарм», затем заразилась COVID-19. А , Б На КТ грудной клетки в осевом направлении (окно легкого) выявлены билатеральные преимущественно периферически расположенные и в меньшей степени бронхоцентрические очаги пневмонии по типу матового стекла. C КТ-объем патологических отделов легких в среднем составляет 1053 куб.см. D КТ-волюметрия общего объема легких составляет в среднем 2204 см3. Итак, 48% легочной паренхимы было поражено (2 балла).
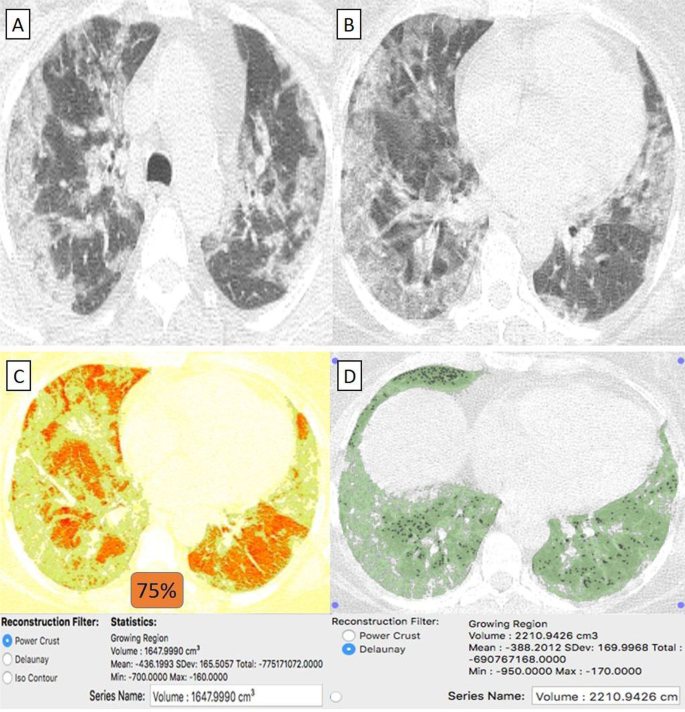
Пациентка 55 лет, перенесшая системную красную волчанку (СКВ) в анамнезе и получившая вакцину «Синофарм», заразилась COVID-19. A , B На КТ грудной клетки в осевом направлении (окно легкого) выявлены билатеральные преимущественно периферически расположенные широко распространенные очаги пневмонии по типу матового стекла. C КТ-объем патологических отделов легких в среднем составляет 1647 куб.см. D КТ-волюметрия общего объема легких составляет в среднем 2210 см3. Итак, поражено 75% паренхимы легкого (3 балла).
«Оксфорд-АстраЗенека» приняла пациентов
Их было 12/55 (22%) пациентов. Их возраст колебался от 41 до 70 лет при соотношении мужчин и женщин 1:3. Классификация сопутствующих заболеваний описана в (табл. 1 ). Клинически у 11 из 12 (91%) пациентов заболевание было легким. По данным КТ-волюмометрии 7 (58%) пациентов набрали (0) баллов и 4 (33%) пациента набрали (1). Между тем, 1/12 (9%) пациентов были клинически тяжелыми, у них наблюдалась «сумасшедшая мостовая» при HRCT, они были госпитализированы и получили оценку (2) (рис. 8 ) . (таблицы 1 , 2 ).
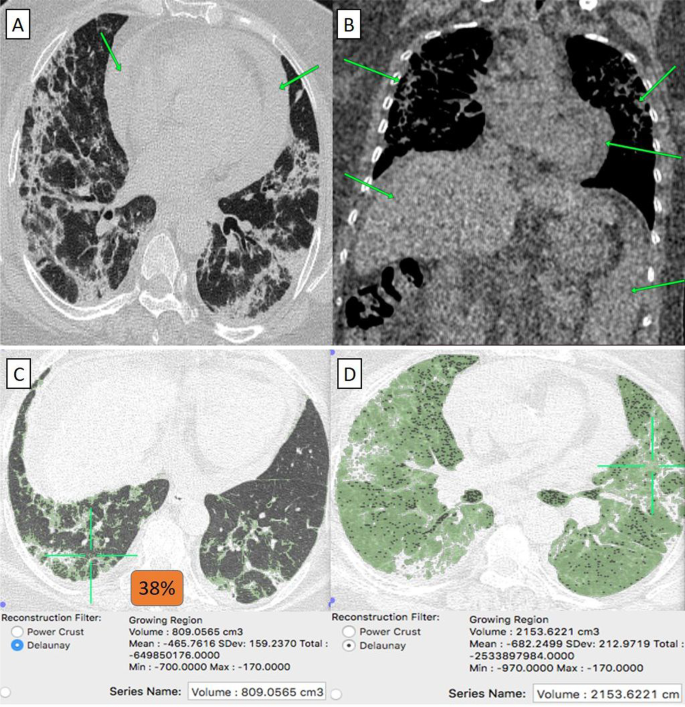
57-летняя женщина-кардиолог с историей цирроза печени, связанного с ВГС, получившая вакцину «Оксфорд-АстраЗенека», затем заразилась COVID-19. Аксиальный КТ-срез грудной клетки (окно легкого) показал двусторонние, преимущественно периферически расположенные гетерогенные пневмонические пятна в виде матового стекла с грубым утолщением перегородки «пятнистый рисунок мощения» и большим количеством перикардиального скопления (зеленые стрелки). B Коронарная КТ грудной клетки и верхней части живота (медиастинальное окно) показала периферические очаги пневмонии, скопление перикарда, цирроз печени и спленомегалию (стрелки) . [D] КТ-волюметрия общего объема легких составляет в среднем 2153 см3. Итак, поражено 38% паренхимы легкого (2 балла).
«Пфайзер-БиоНТех» приняла пациентов
Их было 6/38 (16%) больных. Их возраст колебался от 43 до 69 лет при соотношении мужчин и женщин 1:2. (Таблица 1 ) Все пациенты были клинически легкими. По данным КТ-волюмометрии четыре (67%) пациента набрали (0) и два (33%) пациента набрали (1) балл (рис. 9 ). (таблицы 1 , 2 ).
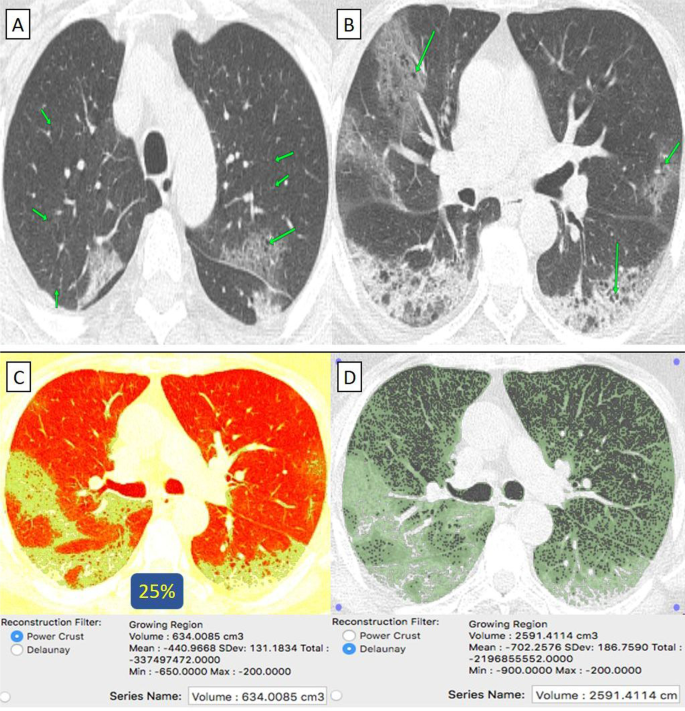
75-летний пациент мужского пола с эмфиземой легких в анамнезе, получивший вакцину «Физер-Бионтех», затем заразился COVID-19. А , Б На аксиальных КТ грудной клетки (окно легкого) выявлена двусторонняя центрилобулярная эмфизема, а также периферические и в меньшей степени бронхоцентрические очаги пневмонии по типу матового стекла с кистозными изменениями. C КТ-объем патологических отделов легких в среднем составляет 634 куб.см. D КТ-волюметрия общего объема легких составляет в среднем 2591 см3. Итак, поражено 25% паренхимы легкого (1 балл).
Иммунодефицитные пациенты со злокачественными новообразованиями в анамнезе
Вакцина «Физер-Бионтек», вакцина «Оксфорд-АстраЗенека» и, в меньшей степени, вакцина «Синофарм» снижали клиническую тяжесть у инфицированных пациентов с ослабленным иммунитетом (в среднем на 17%, 20% и 50% соответственно). по сравнению с 79% тяжести у неиммунизированных пациентов.
Показатели тяжести КТ также снизились у пациентов, получивших вакцины «Физер-Бионтех» и «Оксфорд-АстраЗенека» (2 балла у обеих), и в меньшей степени у пациентов, получивших вакцину «Синофарм» (2–3 балла) в по сравнению с неиммунизированными пациентами (достиг 4 баллов).
Это подробно описано следующим образом:
Неиммунизированные пациенты (контрольная группа)
Их было 14/156 (90%) пациентов. Их возраст колебался от 21 до 67 лет с соотношением мужчин и женщин 2:3. (Таблица 1 ). Клинически 3/14 (21%) пациентов из них были легкими и получили (1) балл по КТ-волюметрии. Между тем, 11 из 14 (79%) пациентов были клинически тяжелыми или критическими, показывали «сумасшедшую мостовую» при КТВР и были госпитализированы. Пять (36%) пациентов набрали (2), четыре (29%) пациента набрали (3) и два (15%) пациента набрали (4). (таблицы 1 , 2 ).
«Синофрам» принял пациентов
Таких пациентов было 10/92 (11%). Их возраст колебался от 34 до 79 лет при соотношении мужчин и женщин 1:4. (Таблица 1 ). Клинически у 5/10 (50%) пациентов заболевание было легким. По данным КТ-волюмометрии 1 (10%) пациент набрал (0) и 4 (40%) пациента набрали (1). Между тем, 5/10 (50%) пациентов были клинически тяжелыми или критическими, показывали «сумасшедшую мостовую» при КТВР и были госпитализированы. Два (20%) пациента набрали (2), два (20%) пациента набрали (3) и один (10%) пациент набрал (4) (рис. 10 ) . (таблицы 1 , 2 ).
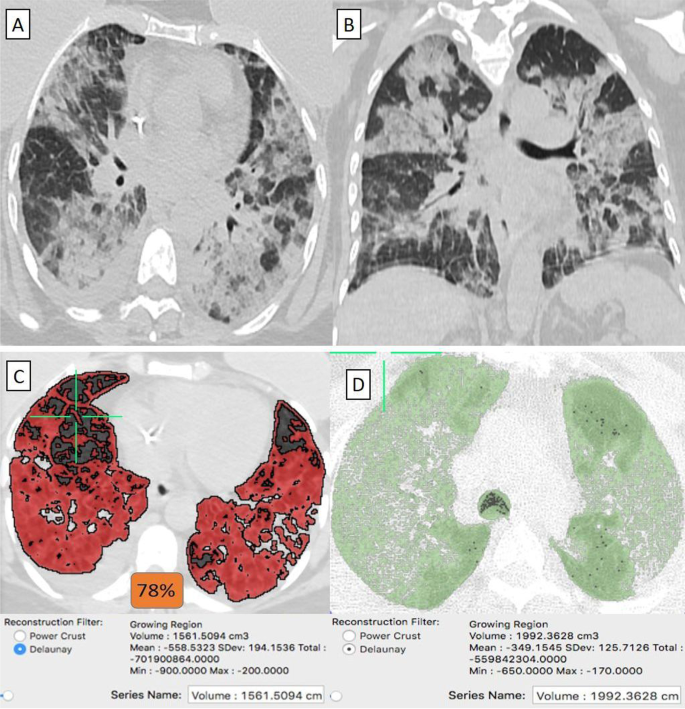
Пациентка 53-х лет с оперированным двусторонним раком молочной железы в анамнезе, получившая вакцину «Синофарм», заразилась COVID-19. Аксиальный и В- коронарный КТ грудной клетки (окно легкого) показали двусторонние широко распространенные большие неоднородные пятна матового стекла с консолидативными изменениями и минимальным правосторонним плевральным скоплением. Грудные имплантаты также заметны в осевых срезах. C КТ-объем патологических отделов легких в среднем составляет 1561 куб.см. D КТ-волюметрия общего объема легких составляет в среднем 1992 см3. Итак, 78% легочной паренхимы поражено (4 балла).
«Оксфорд-АстраЗенека» приняла пациентов
Таких пациентов было 5/55 (9%). Их возраст колебался от 41 до 76 лет при соотношении мужчин и женщин 1:4. (Таблица 1 ). Клинически у 4/5 (80%) пациентов заболевание было легким. По данным КТ-волюмометрии 3 (60%) пациента набрали (0) и один (20%) пациент набрал (1). Между тем, 1/5 (20%) пациентов были клинически тяжелыми, показывали «сумасшедшую мостовую» в HRCT, были госпитализированы и получили оценку (2). (таблицы 1 , 2 ).
«Пфайзер-БиоНТех» приняла пациентов
Их было 6/38 (16%) пациентов. Их возраст колебался от 39 до 73 лет при соотношении мужчин и женщин 2:3. (Таблица 1 ). Клинически у 5/6 (83%) пациентов заболевание было легким. По данным КТ-волюметрии 4 (67%) пациента набрали (0) баллов и один (17%) пациент набрал (1). Между тем, 1/6 (17%) пациентов были клинически тяжелыми, показывали «сумасшедшую мостовую» при HRCT, были госпитализированы и получили баллы (2). (таблицы 1 , 2 ).
Сравнительная эффективность [дисперсионный анализ (ANOVA) с Tukey HSD/Tukey Kramer]: (Таблица 3 )
У пациентов с хорошим общим состоянием здоровья и отсутствием сопутствующей патологии
В дополнение к ранее упомянутым результатам эффективности, основанным на распространенности и соотношении клинических и КТ-оценок тяжести, тестирование ANOVA с Tukey HSD / Tukey Kramer выявило значительные различия в отношении использования «Sinopharm», «Oxford-AstraZeneca». “, и вакцины “Phizer-Biontech” по сравнению с неиммунизированными пациентами ( соотношение f составило в среднем 4,0282, 10,8049 и 8,4404 соответственно, а также значение p в среднем составило 0,04632, 0,001268 и 0,004294, все <0,05). (Таблица 3 ).
Между тем, не было доказано существенной разницы между использованием любого типа вышеупомянутых вакцин по сравнению с остальными. (Таблица 3 ).
У пациентов с сопутствующими заболеваниями
В дополнение к ранее упомянутым результатам эффективности, основанным на распространенности и соотношении клинических и КТ-оценок тяжести, тестирование ANOVA с Tukey HSD / Tukey Kramer выявило значительные различия в отношении использования «Оксфорд-АстраЗенека» и « Phizer-Biontech» по сравнению с неиммунизированными пациентами ( соотношение f в среднем 4,7521 и 4,1682 соответственно, а также значение p в среднем 0,03492 и 0,04857, оба <0,05). (Таблица 3 ).
С другой стороны, несмотря на процент снижения клинической тяжести, результаты тестирования ANOVA ( соотношение f в среднем 0,1784 и значение p в среднем 0,6746 > 0,05) не показали значительных различий в отношении использования «Sinopharm». ” вакцина. (Таблица 3 ).
Следовательно, была доказана значительная разница между применением вакцин «Оксфорд-АстраЗенека» и «Физер-Бионтек» по сравнению с вакциной «Синофарм». Между тем, не было доказано существенной разницы между использованием «Оксфорд-АстраЗенека» и самих вакцин «Физер-Бионтек». (Таблица 3 ).
У пациентов с ослабленным иммунитетом
В дополнение к ранее упомянутым результатам эффективности, основанным на распространенности и соотношении клинических и КТ-оценок тяжести, тестирование ANOVA с Tukey HSD / Tukey Kramer выявило значительные различия в отношении использования «Оксфорд-АстраЗенека» и « Phizer-Biontech” по сравнению с неиммунизированными пациентами ( соотношение f в среднем составляло 11,7811 и 15,6 соответственно, а также значение p в среднем составляло 0,003177 и 0,0009394, оба <0,05). (Таблица 3 ).
С другой стороны, несмотря на процент снижения клинической тяжести, результаты тестирования ANOVA ( соотношение f в среднем 1,4856 и значение p в среднем 0,2358 > 0,05) не показали значительных различий в отношении использования «Sinopharm». ” вакцина. (Таблица 3 ).
Вновь была доказана значительная разница между использованием вакцин «Оксфорд-АстраЗенека» и «Физер-Бионтек» по сравнению с вакциной «Синофарм». Между тем, не было доказано существенной разницы между использованием «Оксфорд-АстраЗенека» и самих вакцин «Физер-Бионтек». (Таблица 3 ).
Глобально у всех пациентов
Тестирование ANOVA с Tukey HSD / Tukey Kramer выявило значительные различия в отношении использования вакцин «Oxford-AstraZeneca» и «Phizer-Biontech» по сравнению с неиммунизированными пациентами (среднее значение коэффициента f составило 18,5913 и 15,6817 соответственно , также значение p в среднем составляло 0,00002495 и 0,0001055, оба <0,05). (Таблица 3 ).
С другой стороны, несмотря на процент снижения клинической тяжести, результаты тестирования ANOVA ( соотношение f в среднем 2,6941 и значение p в среднем 0,102 > 0,05) не показали значительных различий в отношении использования «Sinopharm». ” вакцина. (Таблица 3 ).
Следовательно, была доказана значительная разница между применением вакцин «Оксфорд-АстраЗенека» и «Физер-Бионтек» по сравнению с вакциной «Синофарм». Между тем, не было доказано существенной разницы между использованием «Оксфорд-АстраЗенека» и самих вакцин «Физер-Бионтек». (Таблица 3 ).
Обсуждение
Несколько факторов в настоящее время ответственны за зарегистрированные случаи прорывных инфекций COVID-19. Они включали процент вакцинированных людей, тип доступной вакцины, продолжительность, прошедшую с момента вакцинации, и варианты вируса [ 11 , 12 , 13 , 14 ].
В нескольких клинико-лабораторных исследованиях сравнивалась эффективность различных вакцин в разных странах мира, но было проведено очень мало исследований радиационной роли. Это может быть связано с тем фактом, что потребность в КТ органов грудной клетки значительно снизилась после появления вакцин, особенно среди бессимптомных и слабосимптомных пациентов. Следовательно, требуется большая продолжительность, чтобы получить разумную когорту, включающую пациентов разных возрастных групп, с разным анамнезом и, конечно же, с разным клиническим течением и исходами.
В этом исследовании все пациенты с симптомами имели право на КТ грудной клетки в соответствии с их рабочими правилами, особенно медицинские работники и коллеги. Кроме того, бессимптомные пациенты имели право на КТ грудной клетки до госпитализации по другим причинам, кроме инфекции COVID-19. В конце концов, это увеличило вариации внутри выбранной когорты и уменьшило ее систематическую ошибку. В текущем опыте авторы сравнили три широко распространенных различных вида вакцинации против COVID-19, применяемых в их стране.
Согласно Olliaro P et al. [ 15 ], эффективность вакцинации измерялась путем сравнения показателей заболеваемости без вакцинации и с ней, что называется «снижением относительного риска». Многие другие исследования коррелировали эффективность вакцинации с клиническим исходом заболевания, в частности относительно процента госпитализаций, процента госпитализаций в отделения интенсивной терапии и общего пребывания в стационаре Они коррелировали историю вакцинации с риском снижения, проявляющимся менее вероятным прогрессированием заболевания, необходимостью госпитализации или ИВЛ.
Тенфорд М.В. и соавт. [ 16 ] Клиническое исследование включало 314 вакцинированных и 1669 контрольных пациентов с COVID-19 по сравнению с 185 и 156 пациентами в этом исследовании соответственно. Клиническая тяжесть в их исследовании составила 15,8–21,9% и 54,8–61,8% у вакцинированных и невакцинированных пациентов соответственно по сравнению с 7 и 12,1% в этом исследовании. Более высокий процент клинической тяжести в их исследовании объясняется преобладанием альфа- и дельта-вариантов вируса, в то время как данное исследование проводилось при преобладании дельта- и омикронных вариантов. Госпитализация в их исследовании была в четыре раза больше у пациентов с ослабленным иммунитетом по сравнению с десятикратным увеличением в этом исследовании.
Это исследование совпадает с исследованием Karimi M et al. [ 17 ] клиническое исследование вакцинированных пациентов с COVID-19 с гемоглобинопатиями, в котором тяжесть заболевания была зарегистрирована у 7% пациентов по сравнению с 8% пациентов с различными сопутствующими заболеваниями в этом исследовании.
Это исследование также согласуется с Edan MH et al. [ 18 ] клиническое исследование относительно более сильного иммунитета, обеспечиваемого вакциной «Phizer-BionTech» по сравнению с вакциной «Sinopharm».
Результаты Al-Khazrajy DF et al. [ 19 ] клиническое исследование почти совпало с результатами этого исследования в отношении наличия значительной разницы между иммунитетом пациентов, вакцинированных «Phizer-BionTech» и «AstraZeneca», по сравнению с невакцинированными контрольными пациентами. Их исследование в целом не выявило существенных различий между пациентами, вакцинированными «Синофарм», по сравнению с невакцинированными контрольными пациентами. В текущем исследовании этот результат был ограничен пациентами с заболеваниями и пациентами с ослабленным иммунитетом, в то время как у вакцинированных пациентов без сопутствующих заболеваний была обнаружена значительная дисперсия.
Результаты текущего исследования не совпадают с результатами Ghiasi N et al. [ 20 ] клиническое исследование, в котором сообщалось о 100% защите от клинической тяжести у пациентов, вакцинированных «Синофарм», по сравнению с общим показателем 90% в этом исследовании. В текущем исследовании эта защита дополнительно классифицируется как 97% у пациентов без сопутствующих заболеваний, 90% у пациентов с сопутствующими заболеваниями и 50% у пациентов с ослабленным иммунитетом.
Очень немногие исследования использовали количественную и качественную роль КТ. Они использовали оригинальный полуколичественный метод деления долевых срезов легких.
Ли Дж. Э. и др. [ 21 ] сообщили о положительных результатах КТ грудной клетки с пневмонией у 78% и 41% невакцинированных и вакцинированных пациентов соответственно, по сравнению с 81% и 55% в этом исследовании. Кроме того, это исследование особенно согласуется с Modi SD et al. [ 22 ] относительно низких показателей тяжести КТ у вакцинированных пациентов с сопутствующими заболеваниями по сравнению с невакцинированными пациентами. Это также соответствует аналогичным общим результатам Madhu P et al. [ 2 ] исследование.
Это исследование добавило в литературу новое использование количественных объемных результатов КТ вместо предыдущих полуколичественных методов. Другим преимуществом этого исследования была детальная классификация пациентов по наличию или отсутствию сопутствующих заболеваний или статусу иммунодефицита. Это помогло использовать показатели снижения объемной КТ-оценки наряду с результатами ANOVA для получения более точных результатов. Систематическая ошибка была снижена, насколько это возможно, за счет расширения критериев отбора, включив в него бессимптомных и слабосимптомных пациентов. Кроме того, результаты коррелировали с клинической тяжестью и морфологическими КТ-признаками тяжести, такими как «сумасшедшая мостовая».
Основным ограничением этого исследования было умеренное количество включенных пациентов, а также недостаточные данные о вариантах вируса. Поэтому рекомендуется дальнейшее исследование в более крупной группе с подробными знаниями.
Это исследование не было нацелено на эффективность или безопасность прививок, которые должны быть оценены другими профессиональными исследователями.
Выводы
Это исследование добавило в литературу новое использование количественных объемных результатов КТ вместо предыдущих полуколичественных методов наряду с ANOVA.
Помимо снижения показателей клинической тяжести и показателей тяжести по КТ, была доказана значительная дисперсия в отношении использования вакцин «Синофарм», «Оксфорд-АстраЗенека» и «Физер-Бионтех» у пациентов без сопутствующих заболеваний.
Достоверная дисперсия также была доказана в отношении применения вакцин «Оксфорд-АстраЗенека» и «Физер-Бионтех» у пациентов с сопутствующими заболеваниями и у пациентов с иммунодефицитом.
Несмотря на это, достоверной разницы в применении вакцины «Синофарм» у этих пациентов не доказано, она снижает процент клинической тяжести и баллы тяжести по КТ.
Наличие данных и материалов
Наборы данных, использованные и/или проанализированные в ходе текущего исследования, можно получить у соответствующего автора по обоснованному запросу.