Лента новостей → Радиомика и искусственный интеллект при раке предстательной железы: новые инструменты молекулярно-гибридной визуализации и терагностики
Краткое содержание
При раке предстательной железы (РПЖ) использование новых радиофармацевтических препаратов повысило точность диагностики и стадирования, усовершенствовало стратегии наблюдения и внедрило специфическую и персонализированную радиорецепторную терапию. Таким образом, ядерная медицина имеет большие перспективы для улучшения качества жизни пациентов с РПЖ за счет управления и обработки огромного количества данных молекулярной визуализации и других данных, использования мультиомного подхода и улучшения стратификации риска пациентов для индивидуальной медицины. Искусственный интеллект (ИИ) и радиомика могут позволить клиницистам повысить общую эффективность и точность использования этих «больших данных» как в диагностической, так и в терапевтической области: от технических аспектов (таких как полуавтоматическая сегментация опухоли, реконструкция изображений и интерпретация). ) к клиническим исходам, улучшая более глубокое понимание молекулярной среды РПЖ, уточняя персонализированные стратегии лечения и повышая способность прогнозировать исход. Этот систематический обзор призван описать текущую литературу по ИИ и радиомике, применяемым для молекулярной визуализации рака предстательной железы.
Ключевые моменты
> Применение искусственного интеллекта (ИИ) и радиомикродинамики в ядерной медицине оказывает большую помощь при раке предстательной железы.
>Методы на основе ИИ могут улучшить коррекцию затухания на основе магнитно-резонансной томографии.
>Полностью автоматическая сегментация тканей на основе искусственного интеллекта достигает высокой точности для обнаружения метастазов.
>Рентгенологические признаки могут предсказать агрессивность опухоли лучше, чем стандартизированное значение поглощения.
>Нейронные сети можно даже использовать для упрощения дозиметрии для терагностических приложений.
Введение
Рак простаты
Рак предстательной железы (РПЖ) является серьезной проблемой здравоохранения: по оценкам, во всем мире зарегистрировано почти 1,4 миллиона новых случаев заболевания и 375 000 смертей, при этом показатели заболеваемости колеблются от 6,3 до 83,4 на 100 000 мужчин. РПЖ занимает пятое место среди причин смерти от рака среди мужчин в 2020 г. [1, 2].
Несколько параметров (т. е. статус рецепторов андрогенов, экспрессия генов, модели роста) ответственны за гетерогенность РПЖ и определяют выбор между активным наблюдением за более вялотекущим заболеванием, радикальным лечением (простатэктомия или лучевая терапия) при локализованном заболевании или системной терапией. при распространенном раке [1, 3].
Методы ядерной медицины приобрели значительную актуальность для оценки и лечения РПЖ за последние 5 лет, обеспечивая оценку опухолевой нагрузки всего тела, тем самым различая пациентов с олигометастатическим заболеванием и без него, а также пациентов с обширным заболеванием.
Недавно было разработано несколько номограмм, полученных из комбинации клинических и визуализирующих биомаркеров, для целей диагностики, прогнозирования, прогнозирования или стратификации риска [4, 5]. Однако их валидация для клинического применения требует использования значительного объема данных [1, 3]. Дополнительные возможности открывают радиомика и искусственный интеллект (ИИ), которые потенциально позволяют клиницистам повысить общую эффективность и точность использования огромного количества данных, улучшая более глубокое понимание молекулярной среды РПЖ, уточняя персонализированные стратегии лечения и повышая эффективность лечения. способность прогнозировать результат.
Этот систематический обзор направлен на описание основных концепций и современной литературы по ИИ и радиомике, применяемых для молекулярной визуализации РПЖ.
Ядерная медицина при раке простаты
Наиболее известный радиофармпрепарат в онкологии, 2-дезокси-2-[18F]фтор-D-глюкоза ([18F]ФДГ), имеет лишь ограниченное применение при РПЖ, в основном на поздних стадиях (дедифференцированный, метастатический, резистентный к кастрации РПЖ). — мКРРПЖ), особенно для точного подбора системной терапии [6, 7]. Исторически сложилось так, что радиофармпрепарат холин (обозначенный [18F] или [11C]) с помощью позитронно-эмиссионной томографии (ПЭТ) играл важную роль при РПЖ, в основном для обнаружения биохимического рецидива (БХР), и недавно частично был заменен другими более специфическими радиофармпрепаратами, которые будут обсуждаются ниже. Частота выявления рецидивов заболевания с помощью ПЭТ с холином в условиях БХР зависит от уровня ПСА и варьирует от 36% при ПСА < 1 нг/мл до 73% при ПСА > 3 нг/мл [8, 9]. Другим интересным радиофармпрепаратом РПЖ является [18F]фторциклобутан-1-карбоновая кислота (FACBC), которая улучшила оценку небольших поражений в области таза и предстательной железы по сравнению с холином благодаря его элиминации из желудочно-кишечного тракта/печени (отсутствие/снижение накопления в моче) [18]. 10].
В настоящее время основными действующими лицами при РПЖ являются [68Ga] или [18F] меченые радиофармпрепараты на основе лигандов к простатспецифическому мембранному антигену (PSMA), который в высокой степени экспрессируется клетками рака предстательной железы. В сравнительном исследовании [68Ga]Ga-PSMA-11 показал лучшие результаты, чем [18F]холин, в BCR, с уровнем обнаружения 50% по сравнению с 12% для ПСА <0,5 нг/мл и 69–86% по сравнению с 31%. –57% для более высоких значений ПСА соответственно [11]. Несмотря на некоторые различия [12], аналогичные результаты были также продемонстрированы для [18F]PSMA-1007 при повторном стадировании с суммарной частотой обнаружения 86% для ПСА ≥ 0,5 нг/мл и 49% для ПСА < 0,5 нг/мл [13]. . Однако до 10% поражений РПЖ не экспрессируют ПСМА [14] или имеют специфические особенности, которые снижают их выявляемость радиофармпрепаратами на основе ПСМА [14]. Поэтому в настоящее время исследуются альтернативные радиофармпрепараты, такие как аналоги бомбезина (BBN), уровень обнаружения которых достиг 71,8% у пациентов с обычными негативными изображениями [15]; визуализация рецепторов андрогенов (AR) с помощью [18F]FDHT, которая может быть полезна для оценки осуществимости и эффективности фармацевтических препаратов, направленных на AR [16]; и [18F]NaF для оценки костных метастазов РПЖ [17]. Наконец, интригующим молекулярным сценарием является терагностический подход с радиолигандной терапией (RLT), в основном представленный [177Lu]PSMA. Этот подход показал высокую частоту ответа при распространенном мКРРПЖ в исследованиях фазы II и фазы III с преимуществом в отношении контроля боли в костях и общей выживаемости (ОВ) [18, 19]. РЛТ можно комбинировать с другими онкологическими методами лечения, и такая комбинированная терапия может появиться в ближайшее время. Поэтому будет важно оценить гетерогенность экспрессии ПСМА внутри и среди пациентов, чтобы оптимально отобрать пациентов и выявить потенциальные механизмы резистентности опухоли [20].
Радиомика
Radiomics стремится извлекать большое количество количественных характеристик (признаков) из медицинских изображений, используя алгоритмы характеристики данных и подходы биоинформатики. Эти особенности, а именно рентгенологические признаки (RF), потенциально могут выявить характеристики заболевания, которые невозможно оценить невооруженным глазом, что дает возможность количественно определить специфические атрибуты опухоли и фенотипы. РФ можно разделить по морфологическим признакам, таким как компактность и сферичность; признаки первого порядка, описывающие распределение интенсивностей вокселов в заданном объеме опухоли; статические признаки второго порядка или признаки текстуры, которые могут характеризовать пространственные взаимосвязи интенсивности между вокселами опухоли; и статистические признаки более высокого порядка [21, 22]. Отличительные RF могут помочь лучше описать биологическое поведение болезни в различных условиях и, следовательно, разработать более точные модели поддержки принятия решений путем объединения данных медицинской визуализации (неинвазивных биомаркеров и биомаркеров всего тела) с другими характеристиками пациента, такими как молекулярные и гистопатологические. характеристики опухоли [23].
Искусственный интеллект
Разработка алгоритмов, способных анализировать данные и их свойства с использованием динамических статистических инструментов, которые имеют тенденцию улучшаться или «обучаться» по мере поступления новых данных, подпадает под определение машинного обучения (МО), которое является областью ИИ. В процессе «обучения» эти алгоритмы совершенствуются в использовании и сопоставлении наблюдаемых переменных («признаков» или «предикторов») для разделения выборки данных на наборы переменных результата («метки» или «цели»). Основываясь на «метках», машинное обучение можно разделить на три широких подмножества: контролируемое, неконтролируемое и обучение с подкреплением [24, 25].
Обучение под наблюдением основано на явных наборах данных, которые были помечены оператором; в этом случае алгоритмы измеряют разницу между предсказанными метками и известными метками (так называемая «основная правда»). К этой группе методов машинного обучения относятся линейная и логистическая регрессия, машины опорных векторов (SVM), случайные леса и наивная байесовская классификация [24].
Вместо этого к неконтролируемому обучению относятся анализ основных компонентов, кластеризация методом k-средних и автокодировщики. Здесь алгоритм оптимально разделяет выборки на разные классы, основываясь только на характеристиках обучающих данных, без того, чтобы оператор предварительно определял метки [26].
При обучении с подкреплением компьютер («агент») учится выполнять задачу посредством повторяющихся взаимодействий методом проб и ошибок с динамической средой без явного программирования и без вмешательства человека [26].
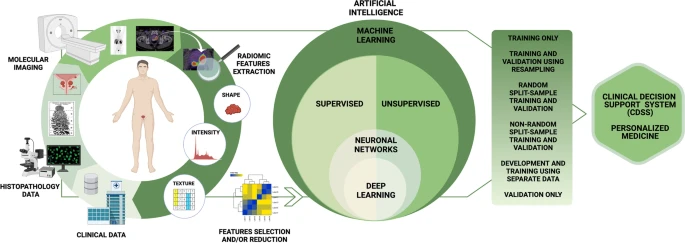
Основываясь на «функциях», методы ML можно разделить на ручные (в которых функции явно извлекаются и выбираются оператором) и неручные подходы, в которых процесс извлечения и выбора функций неявно включен в алгоритм ML. Среди неручных подходов наиболее широко используется глубокое обучение (ГО). DL можно использовать как в контролируемых, так и в неконтролируемых методах обучения. Подходы DL основаны на искусственных нейронных сетях [27], в основном сверточных нейронных сетях (CNN). В основном, в области медицинской визуализации CNN состоят из нескольких слоев и получают необработанное изображение в качестве начального ввода (интересующий набор данных). Затем каждый уровень анализирует и обрабатывает входящие данные (входные данные) с предыдущего уровня, отправляя их на следующий уровень до тех пор, пока из последнего уровня не будут извлечены выходные данные, которые обычно идентифицируют классификационную метку или другое оцениваемое свойство набора данных [28]. . Резюме рабочего процесса радиомики и ИИ при РПЖ представлено на рис. 1.
Рабочий процесс включает шаги, необходимые для радиомикрометрического анализа и анализа искусственного интеллекта у пациентов с раком простаты. Первый этап включает сбор клинических данных о характеристиках пациента, гистопатологических данных о характеристиках опухоли и данных визуализации с выделением рентгенологических признаков (таких как форма, интенсивность и особенности текстуры). Радиомикологическое моделирование включает в себя три основных аспекта: выбор функций, методологию моделирования и проверку. Количество радиомикрометрических признаков, которые можно извлечь из изображений, практически не ограничено. После извлечения необходимо выбрать радиомные признаки; избыточные или ненадежные функции по отношению к источникам изменчивости должны быть идентифицированы и устранены с помощью методов уменьшения размерности, чтобы избежать проблем переобучения. Выбор методологии моделирования и определение оптимальных методов машинного обучения для радиомикрометрических приложений являются важным шагом в получении надежных и клинически значимых результатов. Выбор методологии моделирования (метод машинного обучения с учителем или без учителя) зависит от настройки данных, характеристик анализируемой совокупности и опыта исследователей. Выбранная модель влияет на предсказание и производительность в радиомике, и, следовательно, очень желательны реализации нескольких методологий моделирования. Наконец, методы проверки являются полезными инструментами для оценки производительности модели. Модель, проверенная извне, вызывает больше доверия, чем модель, проверенная внутри, потому что данные, полученные с помощью первого подхода, более независимы. Проверка необходима для проверки повторяемости и воспроизводимости модели, демонстрируя статистическую согласованность между наборами данных для обучения и проверки.