Лента новостей → Может ли ИИ помочь DDR грудной клетки добиться клинического внедрения?
По мнению исследователей из Нью-Йорка, динамическая цифровая рентгенография грудной клетки (DDR), возможно, получила импульс к клиническому использованию у пациентов с заболеваниями легких, поскольку исследователи разрабатывают искусственный интеллект для выполнения трудоемкого анализа, связанного с этой технологией.
Группа из больницы Маунт-Синай разработала «конвейер» сверточных нейронных сетей (CNN) для анализа областей легких в последовательностях изображений DDR пациентов. Они обнаружили, что модель работала достаточно хорошо, чтобы служить заменой стандартным тестам функции легких.
«Наши результаты добавляются к растущим доказательствам того, что РДР является потенциальным суррогатом [функционального теста легких]», — отметили ведущий автор и научный сотрудник по внутренним болезням Валерия Сантибанес, доктор медицинских наук, и его коллеги. Исследование было опубликовано в журнале Chest Pulmonary .
Общие диагностические тесты на легочные заболевания включают рентген грудной клетки и функциональные тесты легких (PFT). Авторы пишут, что, хотя эти тесты и важны, они дают ограниченную статическую оценку. С другой стороны, предыдущие исследования показали, что грудная клетка DDR может фиксировать активное движение легких во время дыхания, предлагая детальное представление о движении легких и диафрагмы .
Авторы отмечают, что DDR относительно легко получить, но препятствиями для его клинического внедрения являются трудоемкий ручной анализ и неясная корреляция со стандартными PFT, отмечают авторы.
С этой целью группа разработала две сверточные нейронные сети (CNN), предназначенные для количественной оценки ключевых измерений в последовательностях изображений DDR. Для получения данных они использовали исследования PFT и DDR 55 пациентов с нормальной, обструктивной и рестриктивной физиологией легких.
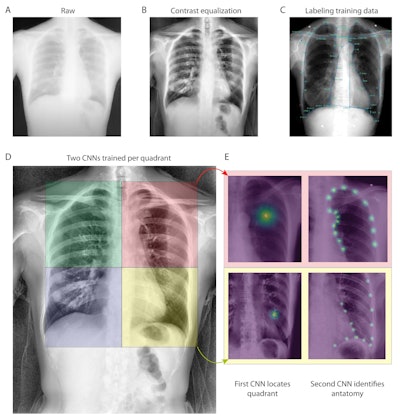
Последовательности DDR были получены с использованием коммерчески доступных машин DDR ( Konica Minolta Healthcare Americas , Уэйн, Нью-Джерси), а CNN были обучены количественно определять площади легких и генерировать то, что группа назвала «PFT на основе DDR» или dPFT. Затем команда сравнила конкретные измерения PFT и dPFT.
Согласно анализу, исследователи наблюдали статистически значимые, сильные корреляции между площадями dPFT и стандартными объемами PFT, включая общую емкость легких (r = 0,764), объем форсированного выдоха за одну секунду (r = 0,591), жизненную емкость легких (r = 0,763). и функциональная остаточная емкость (r = 0,756).
«Статистически значимые корреляции, обнаруженные между dPFT и PFT, позволяют предположить, что dPFT могут выступать в качестве суррогата PFT, когда они недоступны или не могут быть выполнены», — написала группа.
В конечном итоге, отмечают авторы, РДР имеет уникальные преимущества перед традиционными исследованиями. Цифровая технология ограничивает радиационное воздействие на пациентов по сравнению со стандартным рентгеном грудной клетки, пишут они. Более того, хотя PFT жизненно важны для диагностики и мониторинга легочных заболеваний, они создают проблемы с доступностью, например, у пациентов с нервно-мышечными заболеваниями или у тех, кто испытывает обострения хронической обструктивной болезни легких, предположили они.
«Наше исследование демонстрирует надежную корреляцию dPFT и PFT с использованием автоматизированного конвейера анализа DDR. Этот трубопровод имеет потенциал, позволяющий отличать нормальную физиологию от аномальной, что позволяет предположить, что dPFT ценны для оценки динамики легких», — заключила группа.
Полная статья доступна здесь .
Внимание, автоперевод! За ошибки перевода ответственности не несём. Первоисточник по ссылке.
